Гетерогенное равновесие
(для решения требуется авторизация)
Источник: Региональный этап ВсОШ по химии
Оксид магния – одно из самых тугоплавких соединений и поэтому широко применяется для производства огнеупоров. Но из-за высокой температуры плавления MgO непригоден для получения магния методом электролиза и возникает необходимость его перевода в хлорид. Реакция оксида магния с хлором обратима:
MgO(тв) + Cl2(г) ⇄ MgCl2(тв) + ½ O2(г).
Зависимость десятичного логарифма константы равновесия Kp этой реакции от температуры представлена на графике: 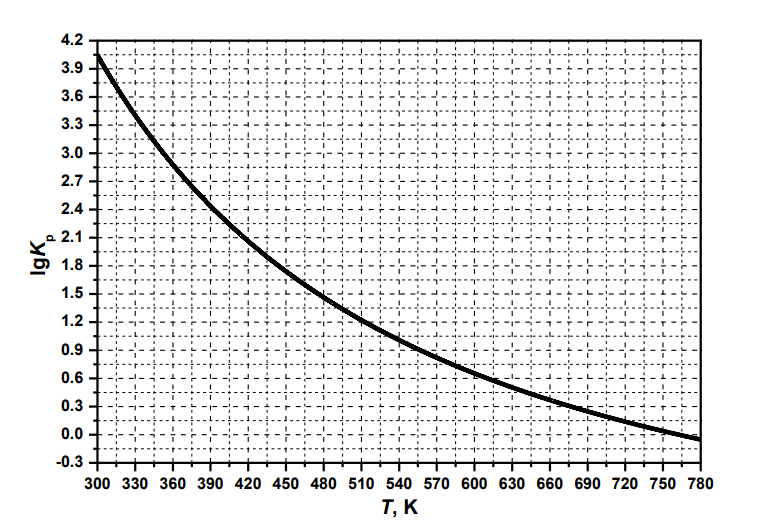
-
Используя график, определите знаки стандартной энтальпии ΔH°, стандартной энтропии ΔS° и стандартной энергии Гиббса ΔG° для этой реакции при температуре 298 К. Ответ обоснуйте. Предположите, почему реакция не протекает при комнатной температуре? В ответ вводите только "<0", ">0" и "=0".
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
В предварительно откачанный закрытый реакционный сосуд объёмом 2.0 л поместили 0.10 г MgO, 0.10 г MgCl2, нагрели до 402 °С и ввели смесь кислорода и хлора (плотность смеси по водороду 25.75) до общего давления 1.0 бар. Для инициирования реакции сосуд подвергли облучению. Рассчитайте состав полученной смеси веществ (массы твердых веществ и давления газов). 1 бар = 105 Па. Массы вводите в г. с точностью до сотых, давления в барах с точностью до тысячных.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
При какой температуре равновесная газовая смесь будет содержать равные количества хлора и кислорода при общем давлении 1 бар? Ответ введите по шкале Кельвина.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
При проведении реакции при температурах выше 1000 °С реакция протекает практически необратимо в прямом направлении. Предложите объяснение этому факту.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Как можно получить хлорид магния из MgO и Cl2 при более низкой температуре? Предложите способ и напишите уравнение реакции.
Решение задачи доступно только авторизованным пользователям — Войти
Решение

