Вещество из водорослей
(для решения требуется авторизация)
Источник: Региональный этап ВсОШ по химии
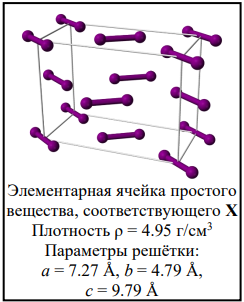 Простое вещество, соответствующее элементу X (его элементарная ячейка представляет собой параллелепипед), было впервые получено при нагревании золы морских водорослей в концентрированной серной кислоте (р-ция 1). Эта реакция сопровождается выделением интенсивно окрашенных паров. Получающееся при этом ростое вещество растворяется в растворе KOH с образованием солей A и B (р-ция 2). Пропускание избытка хлора через щелочной раствор соли B приводит к образованию осадка малорастворимой соли C (р-ция 3). При нагревании С до 580 ⁰С потеря массы составляет 6.96%.
Простое вещество, соответствующее элементу X (его элементарная ячейка представляет собой параллелепипед), было впервые получено при нагревании золы морских водорослей в концентрированной серной кислоте (р-ция 1). Эта реакция сопровождается выделением интенсивно окрашенных паров. Получающееся при этом ростое вещество растворяется в растворе KOH с образованием солей A и B (р-ция 2). Пропускание избытка хлора через щелочной раствор соли B приводит к образованию осадка малорастворимой соли C (р-ция 3). При нагревании С до 580 ⁰С потеря массы составляет 6.96%.
Кислоты AH и BH, соответствующие упомянутым солям, – достаточно сильные одноосновные кислоты. Из раствора натриевой соли кислоты BH и NaOH при пропускании хлора выпадет осадок малорастворимой соли D (р-ция 4).
При взаимодействии 0.125 г D c избытком подкисленного серной кислотой раствора A образуется тёмно-окрашенный раствор (р-ция 5). Для его полного обесцвечивания необходимо добавить 34.0 мл раствора Na2S2O3 с концентрацией 0.100 моль/л (р-ция 6).
Из солей D и E можно получить весьма необычное вещество F. К раствору солей D и E, подкисленному серной кислотой, добавляют пероксодисульфат натрия и нагревают (р-ция 7). В ходе реакции цвет раствора меняется с зелёного на тёмно-фиолетовый, и начинает выпадать тёмный осадок кристаллогидрата F.
Для анализа полученного чёрного вещества F, его высушили на воздухе, навеску массой 0.284 г растворили в 2М растворе H2SO4 и пропустили ток сернистого газа до прекращения реакций. Раствор разделили на две равные части. К первой части добавили избыток нитрата серебра, выпал осадок, масса которого составила 0.103 г. Ко второй части раствора добавили аммиак до нейтральной среды и затем спиртовой раствор диметилглиоксима. Масса выпавшего осадка составила 0.127 г. Известно, что анализируемый элемент реагирует с диметилглиоксимом в соотношении 1:2.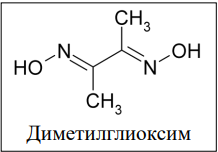
Водный раствор зеленого цвета, содержащий 1.200 г соли E, цвета при реакции с избытком раствора нитрата бария даёт 0.997 г белого осадка, нерастворимого в кислотах и щелочах (р-ция 8).
-
Определите элемент X. Ответ подтвердите расчётом.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Напишите формулы веществ A – F. Состав солей C – F подтвердите расчётом.
В солях С и D анионы различные, изобразите структурную формулу аниона соли D.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Напишите уравнения реакций 1 – 8. Считайте, что в реакции 1 вместо морских водорослей реагирует твёрдое вещество A.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Сравните поведение соли A в реакции 1 с поведением аналогичных твёрдых бинарных солей, содержащих элементы, находящиеся в одной группе с X, молярные массы которых отличаются от X менее чем в 4 раза. Напишите уравнения этих реакций (9 и 10).
В качестве ответа указывайте сумму коэффициентов реакции.
Решение задачи доступно только авторизованным пользователям — Войти
Решение

