Цикл Борна-Габера
(для решения требуется авторизация)
Источник: ЗЭ ВООШ 2012-2013 гг. 10 класс
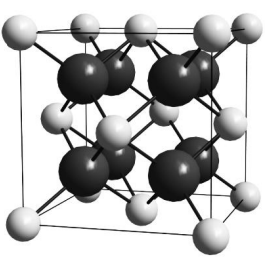
Высокая устойчивость большинства солей обусловлена прочной кристаллической решёткой, составленной из ионов. Например, кристаллическую структуру фторида кальция можно представить как бесконечно повторяющиеся в пространстве кубики (называемые элементарной ячейкой) со стороной 0,546 нм. В вершинах и центрах граней кубиков располагаются катионы кальция, а в тетраэдрических пустотах анионы фтора, т. е. каждый анион F- окружён четырьмя катионами Ca2+, а каждый катион Ca2+ – восемью анионами F− (см. рис.).
-
Напишите электронные конфигурации Ca, Ca2+, F и F−. Каждую орбиталь пишите через пробел.(Пример для N: 1s2 2s2 2p3)
.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Рассчитайте количество формульных единиц CaF2, приходящихся на одну элементарную ячейку, и плотность кристалла фторида кальция (г/см3). 1 нм = 10-9 м.
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
В природе фторид кальция встречается в виде минерала, мировая добыча которого составляет более 3 млн. тонн в год. Вспомните название минерала и укажите, для каких целей используют добываемый CaF2 (два примера).
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Лабораторный способ получения фторида кальция основан на взаимодействии карбоната кальция с плавиковой кислотой. В расчете на 1 г карбоната кальция выделяется 1,56 кДж теплоты.
Приведите термохимическое уравнение описанной реакции и рассчитайте теплоту образования фторида кальция, если известны следующие теплоты образования:

Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
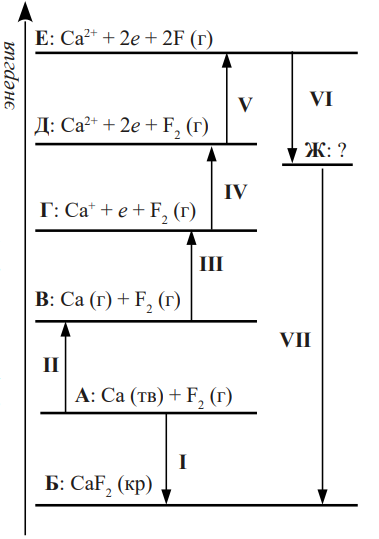
Немецкие учёные Макс Борн и Фриц Габер предложили подход для определения энергий ионных кристаллических решёток, который сегодня известен как цикл Борна–Габера, изображаемый с помощью энергетической диаграммы. Данный подход базируется на законе Гесса. Каждой горизонтальной черте на энергетической диаграмме (масштаб не соблюдён) соответствует определённое состояние (обозначены буквами), а вертикальными стрелками обозначены процессы перехода из одного состояния в другое. Энергии некоторых процессов представлены в таблице:

Сформулируйте закон русского химика шведского происхождения Г. И. Гесса.
-
Энергия, выделяющаяся в процессе I, называется теплотой образования CaF2. Как называются значения энергий, затрачиваемых для осуществления процессов II–VII?
Решение задачи доступно только авторизованным пользователям — Войти
Решение
-
Какие частицы отвечают состоянию Ж? Приведите уравнения реакций, соответствующих процессам VI и VII.
Рассчитайте энергию кристаллической решётки фторида кальция.
Решение задачи доступно только авторизованным пользователям — Войти
Решение

